Tại sao ∆G = ∆H – T∆S là phương trình quan trọng nhất trong hóa sinh?
∆G = ∆H – T∆S là một trong những công thức trừu tượng nhất trong khoa học, nhưng cũng là một trong những công thức quan trọng nhất. Không có nó, sự sống không thể tồn tại.
· 10 phút đọc lượt xem.
∆G = ∆H – T∆S là một trong những công thức trừu tượng nhất trong khoa học, nhưng cũng là một trong những công thức quan trọng nhất. Không có nó, sự sống không thể tồn tại.
Hóa sinh là ngành học về các phản ứng hóa học có ý nghĩa sinh học – chủ yếu là các phản ứng liên quan đến các hợp chất hữu cơ (chứa cacbon). Một trong những chủ đề chính của hóa sinh là tìm hiểu các phản ứng hóa học nào xảy ra trong sinh vật sống và lý do tại sao. Và phương trình chính mô tả điều này là: ∆G = ∆H – T∆S.
Nói một cách dễ hiểu, phương trình này có nghĩa là sự thay đổi của năng lượng tự do (G) bằng với sự thay đổi của enthalpy (H) trừ đi nhiệt độ (T) nhân với sự thay đổi của entropy (S). Điều này có làm mọi thứ rõ ràng hơn không? Có lẽ là không.
∆G = ∆H – T∆S
Để hiểu được phương trình cực kỳ trừu tượng này, chúng ta hãy phân tích nó. Bất cứ khi nào xuất hiện delta (∆), điều đó có nghĩa là sự thay đổi của. Ví dụ, nếu chúng ta bắt đầu với bảy cái bánh quy và giờ chỉ còn hai cái, sự thay đổi của (∆) bánh quy là -5. Lý do chúng ta đo lường sự thay đổi (∆) là vì giá trị ban đầu có thể rất khó, nếu không muốn nói là không thể, để đo lường. Trừ nhiệt độ (T), không có giá trị nào khác có thể đo lường trực tiếp. Chúng ta chỉ có thể đo lường sự thay đổi.
Năng lượng tự do (G) ám chỉ năng lượng có sẵn để thực hiện công việc hữu ích. Khi bạn sử dụng máy tính xách tay hoặc điện thoại thông minh, pin không thể thực hiện công việc hữu ích với toàn bộ năng lượng được lưu trữ. Làm sao chúng ta biết điều đó? Vì các thiết bị điện tử đó nóng lên. Điều này không nên xảy ra trong một thế giới lý tưởng; đó là năng lượng bị lãng phí. Nhưng không có gì chúng ta có thể làm được vì chúng ta không sống trong một thế giới lý tưởng. (Sẽ nói thêm về điều này sau.) Do đó, sự thay đổi của năng lượng tự do (∆G) luôn nhỏ hơn tổng lượng năng lượng có thể đã được khai thác cho công việc hữu ích.
Enthalpy (H) là một khái niệm khá kỳ lạ mà các nhà hóa học đã sáng tạo ra để giúp họ hiểu các thay đổi về năng lượng trong quá trình phản ứng hóa học. Sự thay đổi của enthalpy (∆H) thực chất là sự thay đổi của nhiệt. (Điều này có phần phức tạp hơn, vì nó cũng bao gồm công việc áp suất – thể tích. May mắn thay, điều này thường không đáng kể và có thể bỏ qua.) Phản ứng hóa học hoặc hấp thụ nhiệt (và trở nên lạnh khi chạm vào) hoặc phát nhiệt (và trở nên nóng khi chạm vào), và sự thay đổi của enthalpy (∆H) đo lường điều này.
T∆S, thành phần cuối cùng của phương trình
Thành phần cuối cùng là T∆S, biểu diễn tích của nhiệt độ (T) và sự thay đổi của entropy (∆S). Hãy nhớ về thế giới lý tưởng của pin hoàn hảo mà chúng ta không sống trong đó chứ? Định luật thứ hai của nhiệt động học cho biết entropy (S, có thể hiểu là năng lượng thải hoặc mức độ hỗn loạn hay hỗn độn) luôn tăng lên trong Vũ trụ. Bạn có thể coi entropy như một dạng thuế mà Vũ trụ thu cho mỗi lần chuyển giao năng lượng. T∆S, biểu diễn lượng thuế này, phải được trừ đi từ ∆H.
Hãy thử phát biểu lại phương trình ∆G = ∆H – T∆S bằng tiếng Anh giản dị: Sự thay đổi của lượng năng lượng có sẵn để thực hiện công việc hữu ích (∆G) bằng với sự thay đổi của nhiệt (một dạng truyền năng lượng) của một phản ứng hóa học (∆H) trừ đi một số thuế không tưởng mà Vũ trụ thu (T∆S).
∆G quyết định liệu một phản ứng hóa học có thể xảy ra
Tốt. Điều đó có liên quan gì đến sự sống? Rất vui vì bạn đã hỏi!
Sự sống rất phức tạp, và nó đòi hỏi nhiều phản ứng hóa học không xảy ra một cách tự nhiên. Một phản ứng tự nhiên xảy ra mà không cần can thiệp. Nếu để tự diễn ra (tức là không có sự truyền năng lượng), phản ứng hóa học sẽ tự diễn ra. Lưu ý rằng điều này không liên quan đến tốc độ. Một phản ứng tự nhiên có thể rất nhanh hoặc rất chậm. Ăn mòn do rỉ sét là một quá trình tự nhiên, nhưng mất rất lâu.
Để các tế bào của cơ thể bạn tồn tại, chúng cần thực hiện cả phản ứng tự nhiên và không tự nhiên. (Một ví dụ về phản ứng không tự nhiên là xây dựng một protein.) Cách mà một tế bào có thể thực hiện phản ứng không tự nhiên là liên kết một phản ứng tự nhiên (phản ứng có lợi về năng lượng và giải phóng năng lượng tự do) với một phản ứng không tự nhiên (phản ứng không có lợi về năng lượng và cần một nguồn năng lượng tự do). Miễn là quá trình tổng thể có kết quả là giải phóng năng lượng tự do (theo quy ước, chúng ta coi đây là giá trị ∆G âm), phản ứng có thể tiến hành.
Hình dưới đây cho thấy một loạt các phản ứng hóa học rất điển hình trong một tế bào. Một tế bào có thể khai thác năng lượng tự do từ glucose (-∆G) để sản xuất một phân tử trung gian và giàu năng lượng (gọi là ATP) thúc đẩy quá trình tổng hợp protein, quá trình này đòi hỏi một nguồn năng lượng tự do (+∆G). Vì quá trình tổng thể có kết quả là giải phóng năng lượng tự do (-∆G), phản ứng có thể tiến hành.
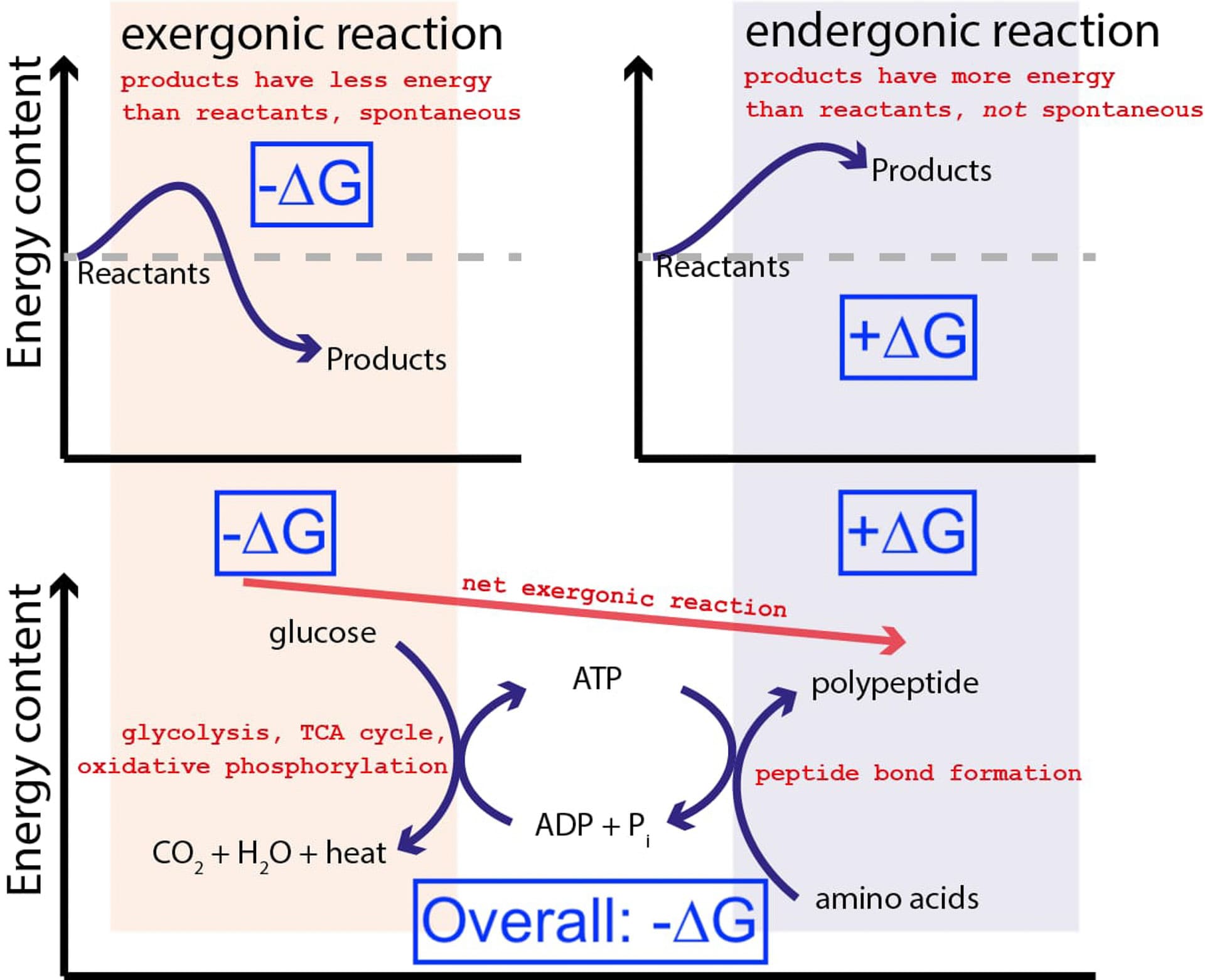
Nếu các tế bào của chúng ta không có khả năng thực hiện các phản ứng hóa học không tự nhiên, không có lợi về năng lượng (+∆G) bằng cách sử dụng các phản ứng tự nhiên, có lợi về năng lượng ( – ∆G), thì sự sống không thể tồn tại. Đó là lý do tại sao ∆G = ∆H – T∆S là phương trình quan trọng nhất trong hóa sinh.
Tài liệu bổ sung:
∆G = ∆G° + RT ln( [C][D] / [A][B] )
Như thường lệ, khoa học phức tạp hơn nhiều. Xem xét một phản ứng hóa học chung có dạng: A + B ⇌ C + D, trong đó A và B là các chất phản ứng và C và D là sản phẩm. Phương trình quan trọng nhất trong hóa sinh thực tế là một định nghĩa khác về sự thay đổi năng lượng tự do (∆G):
∆G = ∆G° + RT ln( [C][D] / [A][B] )
Phương trình này không dễ dàng để giải thích nhanh chóng, nhưng ý chính là sự thay đổi năng lượng tự do (∆G) phụ thuộc vào bản chất vốn có của các chất phản ứng và sản phẩm (∆G°) cộng với một hằng số (R) nhân với nhiệt độ (T) nhân với logarithm tự nhiên (ln) của tích nồng độ của C và D (tức là, [C] nhân với [D]) chia cho tích nồng độ của A và B (tức là, [A] nhân với [B]).
∆G°, được gọi là thay đổi năng lượng tự do tiêu chuẩn tại pH 7, là một giá trị được tính khi tất cả các sản phẩm (C và D) và các chất phản ứng (A và B) ban đầu có mặt ở nồng độ 1M (1 mol/lít) ở áp suất 1 atmosphere ở 25°C. Dưới các điều kiện tiêu chuẩn này – các điều kiện nhân tạo chỉ có trong ống nghiệm trong phòng thí nghiệm – nồng độ của các chất phản ứng ([A] và [B]) và của các sản phẩm ([C] và [D]) sẽ luôn ổn định ở các giá trị rất cụ thể tùy thuộc vào bản chất của phản ứng hóa học. Giá trị Keq là một hằng số duy nhất đối với mỗi phản ứng hóa học và được tính bằng cách nhân nồng độ cuối cùng của các sản phẩm ([C] nhân với [D]), sau đó chia cho tích nồng độ của các chất phản ứng ([A] nhân với [B]).
Keq = [C][D] / [A][B]
Vì Keq là một hằng số, R là một hằng số và nhiệt độ (T) được xác định là 25°C dưới điều kiện tiêu chuẩn (cũng là một hằng số), giá trị ∆G° là một hằng số độc nhất cho mỗi phản ứng hóa học.
∆G° = -RT ln(Keq)
Nhưng điều này còn phức tạp hơn nữa. Liệu một phản ứng có tự nhiên hay không phụ thuộc vào ∆G, không phải ∆G°. Điều kiện bên trong một tế bào không phải là điều kiện tiêu chuẩn. Các chất phản ứng và sản phẩm không bao giờ ở nồng độ 1M mỗi chất, và nhiệt độ không phải là 25°C. Vì vậy, tính toán ∆G đòi hỏi phải xem xét các yếu tố đó, và đó là cách chúng ta đến với công thức ở trên:
∆G = ∆G° + RT ln( [C][D] / [A][B] )
Hãy thử dịch điều này sang tiếng Anh giản dị: Sự thay đổi của năng lượng tự do có sẵn để thực hiện công việc hữu ích (∆G) bằng với sự thay đổi năng lượng tự do đặc trưng cho các chất phản ứng và sản phẩm cụ thể được sử dụng dưới điều kiện phòng thí nghiệm nhân tạo (∆G°) cộng với một hằng số (R) nhân với nhiệt độ thực tế (T) nhân với logarithm tự nhiên (ln) của tích nồng độ thực tế của C và D bên trong tế bào (tức là, thực tế [C] nhân thực tế [D]) chia cho tích nồng độ thực tế của A và B bên trong tế bào (tức là, thực tế [A] nhân thực tế [B]). Nếu sau tất cả các tính toán, ∆G là âm, phản ứng là tự nhiên.







